Page 78 - 第九版生物化学
P. 78
厂
第三章酶与酶促反应 63
芘..,,201, 癹..,, 201 ,
HOB: .. /
、 BH 0
H+ 入。H
" " ' )R 2 - N - C - R 1 ? 0 R, 钾:i,
I II
H0 + O=C-R1
—R2 NH2
图 3-10 胰凝乳蛋白酶的催化机制
第三节 酶促反应动力学
酶促反应动力学 (kinetics of enzyme-catalyzed reactions) 是研究酶促反应速率以及各种因素对酶促
反应速率影响机制的科学 。 酶促反应速率可受多种因素的影响,如酶浓度、底物浓度 、 pH 、 温度、抑制
剂及激活剂等 。 研究酶促反应动力学具有重要的理论和实践意义 。
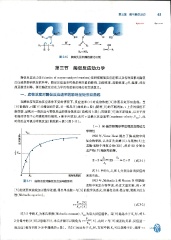
一、底物浓度对酶促反应速率的影响呈矩形双曲线
在酶浓度和其他反应条件不变的情况下,反应速率 (V) 对底物浓度[ s] 作图呈矩形双曲线 。 当
[ s] 很低时, v 随 [SJ 的增加而升高,呈一级反应(曲线的 a 段);随着[ s] 的不断增加, v 上升的幅度不
断变缓,呈现出一级反应与零级反应的混合级反应(曲线的 b 段);再随着[ s] 的不断增加,以至千所
有酶的活性中心均被底物所饱和, v 便不再增加,此时 v 达最大反应速率 (maximum velocity, V'""") , 此
时的反应可视为零级反应(曲线的 c 段)(图 3-11) 。
(一)米曼方程揭示单底物反应的动力
V} 学特性
恲 i} 1902 年, Victor Henri 提出了酶-底物中间
A 复合物学说,认为首先是酶 (E) 与底物 (s) 生
成酶-底物中间复合物 (ES), 然后 ES 分解生
龄
话
赵
T1 V-,一一一一一一 成产物 (P) 和游离的酶。
k1 k3 (式 3-1)
E + S~ES------? E +P
k2
式 3-1 中的 kl 、 k2 和 k3 分别为各向反应的
0 K., 底物浓度[SJ 速率常数 。
图 3-11 底物浓度对酶促反应速率的影响 1913 年, Michaelis L 和 Menten M 根据酶-
底物中间复合物学说,经过大量实验,将 v 对
[ s] 的矩形双曲线加以数学处理,得出单底物 v 与[ s] 的数学关系式,即著名的米-曼方程,简称米氏方
程 (Michaelis equation) 。
Vm.. [S] (式 3-2)
v= 凡 +[SJ
式 3-2 中的凡为米氏常数 (M呻aelis constant) , Vmax 为最大反应速率。当 [SJ 远远小于凡时,式 3- ~OTT. t a
2 分母中的[ s] 可以忽略不计,米氏方程可以简化为 v= 二V竺[ SJ, 此时 v 与[ s] 成正比关系,反应呈一
级反应(相当于图 3-10 中曲线的 a 段) 。 当[ s] 远远大于Km凡时,方程中的凡可以忽略不计,此时 V=