Page 75 - 第九版生物化学
P. 75
60 第—篇 生物大分子结构与功能
镜面 COOH 免 kk y,2018 COOH 完 kky,2018
COOH COOH HO —cI —H f=o乳酸脱氢酶 I
二~'\ :c
阮
NAD+ NADH+tt+ CH3
L-乳酸
丙酮酸
HO COOH 乳酸脱氢酶 ?X
CH3
CH3 I /
L-乳酸
几乳酸 H-C-OH NAD+
阮
D-乳酸
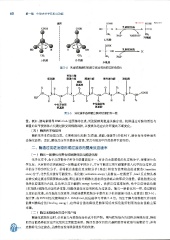
图 3 - 4 乳酸脱氢酶对乳酸立体异构体的选择性催化
氨肮酶 胃蛋白酶 胰 蛋白 酶 弹性蛋白 酶 狻肤酶
糜蛋白酶 夕 /
碱性
f Ra HRi1eH 酸
0 。 比 H
\ l Ic | // 1 拉 __
中 吕 N] 昙比 皿酸HlN 1 1
冒 C c ` N/ H C ]` N ] CIvIO/' N ] C c/ 。 。 H
\ CII/ O H ] \ CIIO H x1 _ H
I / I
/ 中 c
、— H 比I
H
R 香 族
l 酸
图 3-5 消化道中各种蛋白酶对肤键的专一性
量 。 例如,胰岛素诱导 HMG-CoA 还原酶的合成,而胆固醇则阻遏该酶合成 。 机体通过对酶的活性与
酶量的调节使得体内代谢过程受到精确调控,以使机体适应内外环境的不断变化 。
(四)酶具有不稳定性
酶的化学本质是蛋白质 。 在某些理化因素(如高温、强酸、强碱等)的作用下,酶会发生变性而失
去催化活性 。 因此,酶促反应往往都是在常温、常压和接近中性的条件下进行的 。
二、酶通过促进底物形成过渡态而提高反应速率
(一)酶比一般催化剂更有效地降低反应的活化能
化学反应中,由千反应物分子所含的能 量 高低不一,所含自由能较低的反应物分子,很难发生化
学反应 。 只有那些达到或超过一定能量水平的分子,才有可能发生相互碰撞并进入化学反应过程,这
样的分子称为活化分子 。 若将低自由能的反应物分子(基态)转变为能量较高的过渡态 (transition
state) 分子,化学反应就有可能发生 。 活化能 (activation energy) 是指在一定温度下, lmol 反应物从基
态转变成过渡态所需要的自由能,即过渡态中间物比基态反应物高出的那部分能量 。 活化能是决定
化学反应速率的内因,是化学反应的能障 (energy barrier) 。 欲使反应速率加快,给予反应物活化能
(如加热)或降低反应的活化能,均能使基态反应物转化为过渡态 。 酶与一般催化剂一样,通过降低
反应的活化能,从而提高反应速率,但酶能使其底物分子获得更少的能蜇便可进入过渡态(图 3-6) 。
据计算,在 25°C 时活化能每减少 4. 184kJ/ mol , 反应速率可增高 5.4 倍 。 衍生于酶与底物相互作用的
能 量 叫做结合能 (binding energy) , 这种结合能的释放是酶降低反应活化能所利用的自由能的主要
来源 。
(二)酶与底物结合形成中间产物
@ 酶催化底物反应时 , 必须首先与底物结合形成中间产物 。 酶与底物结合的过程是释能反应,释放
的结合能是降低反应活化能的主要能 量来源 。 酶活性部位的结合基团能否有效地与底物结合,并将
底物转化为过渡态,是酶能否发挥其催化作用的关键 。