Page 73 - 第九版生物化学
P. 73
58 第—篇 生物大分子结构与功能
1/'Jkk y,2 018 父 kky,2018
三、同工酶催化相同的化学反应
同工酶 (isoenzyme 或 isozyme) 是指催化相同的化学反应,但酶蛋白的分子结构、理化性质乃至免
疫学性质不同的一组酶 。 同工酶虽然在一级结构上存在差异,但其活性中心的 三维结 构相同或相似,
故可以催化相同的化学反应 。 同工酶是长期进化过程中基因趋异 (divergence) 的产物,因此从分子遗
传学角度同工酶也可解释为”由不同基因或复等位基因编码,催化相同反应,但呈现不同功能的一组
酶的多态型”。由同一基因转录的 mRNA 前体经过不同的剪接过程,生成的多种不同 mRNA 的翻译
产物(一系列酶)也属千同工酶 。
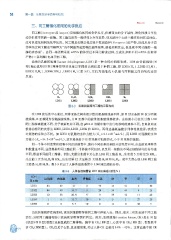
动物的乳酸脱氢酶 (lactate dehydrogenase, LDH) 是一种含锌的四聚体酶 。 LDH 由骨骼肌型 (M
型)和心肌型 (H 型)两种类型的亚基以不同的比例组成 5 种同工酶,即 LDHl (H4) , LDH2 (H3 M) 、
LDH3(H2 队) 、 LDH4(HM3) 、 LDH5 (M4) (图 3-3) , 它们均能催化 L-乳酸与丙酮酸之间的氧化还原
反应 。
```王~ H3M1 H2M2 HM3 mMi
LDHS
LDHl LDH2 LDH3 LDH4
图 3-3 乳酸脱氢酶同工酶的亚基构成
在 LDH 的活性中心附近,两种亚基之间有极少数的氨基酸残基不同,如 M 型亚基的 30 位为丙氨
酸残基, H 亚基则为谷氨酰胺残基,且 H 亚基中的酸性氨基酸残基较多 。 这些微小的差别引起 LDH
同工酶解离程度不同 、 分子表面电荷不同,在 pH 8. 6 的缓冲液中进行电泳时的速率不同,自负极向正
极泳动排列的次序为 LDH5 、 LDH4 、 LDH3 、 LDH2 和 LDHl 。 两种亚基氨基酸序列和构象差异,表现出
对底物的亲和力不同 。 如 LDHl 对乳酸的亲和力较大 (Km = 4. 1xl0-3moVL), 而 LDH5 对乳酸的亲和
力较小 (Km= 14. 3xl0-3moVL), 这主要是由于 H 型亚基对乳酸的凡小千 M 亚基的缘故 。
同一个体不同发育阶段和不同组织器官中,编码不同亚基的基因开放程度不同,合成的亚基种类
和数量也不同,这使得某种同工酶在同一个体的不同组织,以及同一细胞的不同亚细胞结构的分布也
不同,形成不同的同工酶谱 。 例如,大鼠出生前 9 天心肌 LDH 同工酶是 M4, 出生前 5 天转变为 HM3,
出生前 1 天为 H2 队和 HM3, 出生后第 12 天至第 21 天则是 H3M 和 H2M2 。 成年大鼠心肌 LDH 同工酶
主要是比和 H3M 。表 3-3 列出了人体各组织器官中 LDH 同工酶的分布 。
表 3 -3 人体各组织器官 L DH 同工酶谱(活性%)
LOH 红细胞 白细胞 血清 骨骼肌 心肌 .肺 T 肾 ·肝 脾
同工酶 ,, 43 12 27 ___ "' 。 -- - 73 14 43 2 10
49 . 34 44 4 25
LDHl 44 33 _,一..,. 24 40
LDH2 12 6 ~呱- 11 20
LDH3 1 3 5
LDH4 。 34. 7 . . 0 27
LDH5 。 。 56
忐 ?l _ . , . 稠去一 。
20.9 5 35 12
,.一 1
..., 气:"!"'- - -'盲飞` 口5 ,一,一.
11. 7 16
"""'OIT盲-
5. 7 79 12 。
当组织细胞存在病变时,该组织细胞特异的同工酶可释放入血。因此,临床上检测血清中同工酶
活性、分析同工酶谱有助千疾病的诊断和预后判定 。 例如,肌酸激酶 (creatine kinase, CK) 是由 M 型
(肌型)和 B 型(脑型)亚基组成的二聚体酶 。 脑中含 CK1(BB 型),心肌中含 CK2( MB 型),骨骼肌中
含 CK3(MM 型)。 CK2 仅见于心肌,且含量很高,约占人体 CK 总量的 14% -42% 。 正常血液中的 CK