Page 33 - 第九版生物化学
P. 33
18 第一 篇 生物大分子结构与功能 免 kk y , 2 018 癹 kky,2018
在许多蛋白质分子中,可由 2 个或 2 个以上具有二级结构的肤段在空间上相互接近,形成一个有
规则的二级结构组合,称为超二级结构,此概念由 M. G. Rossman 千 1973 年提出 。 目前已知的 二 级结
构组合有四、 B哗、部等几种形式(图 1-15) 。 研究发现, a.-螺旋之间 、 ~-折叠之间以及 a.-螺旋与~-折
叠之间的相互作用,主要是由非极性氨基酸残基参与的 。
N
(a) c (c)
N
c (b)
N
(d) (e)
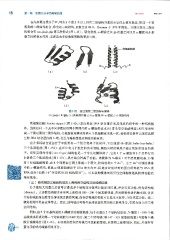
图 1-15 蛋白质超二级结构与模体
(a) 加队 (b) 部; (c) 亮氨酸拉链; (d) a-螺旋环 -a-螺旋; (e) 锌指结构
亮氨酸拉链 (leucine zipper) (图 l-15c) 是出现在 DNA 结合蛋白和其他蛋白质中的一种结构模
体。当来自同一个或不同多肤链的两个两用性的 (X-螺旋的疏水面(常含有亮氨酸残基)相互作用形
成一个圈对圈的二聚体结构,亮氨酸有规律地每隔 6 个氨基酸就出现一次,亮氨酸拉链常出现在真核
生物 DNA 结合蛋白的 C-端,往往与癌基因表达调控功能有关 。
在许多钙结合蛋白分子中通常有一个结合钙离子的模体,它由螺旋 -环-螺旋 (helix -loop-helix)
三个肤段组成(图 l -15d), 在环中有几个恒定的亲水侧链,侧链末端的氧原子通过 氢 键而结合钙离
酗 子 。 近年发现的锌指 (zinc finger) 结构也是一个常见的模体例子,它由 1 个 (X-螺旋和 2 个反平行的
B 折叠三个肤段组成(图 l-15e), 具有结合锌离子功能 。 该模体的 N -端有 1 对半胱氨酸残基, C-端
有 1 对组氨酸残基,此 4 个残基在空间上形成一个洞穴,恰好容纳 l 个 Zn2? 。 由于 Zn2? 可稳固模体
中的 a-螺旋结构,使此 (X-螺旋能镶嵌于 DNA 的大沟中,因此含锌指结构的蛋白质都能与 DNA 或
RNA 结合(动画 1-5" 锌指结构 3D 结构展示") 。 可见结构模体的特征性空间构象是其特殊功能的
结构基础 。
(三)结构域是三级结构层次上具有独立结构与功能的区域
分子量较大的蛋白质常可折叠成多个结构较为紧密且稳定的区域,并各行其功能,称为结构域
(domain) 。 大多数结构域含有序列上连续的 100 -200 个氨基酸残基,若用限制性蛋白酶水解,含多
个结构域的蛋白质常分解出独立的结构域,而各结构域的构象可以基本不改变,并保持其功能 。 超二
级结构则不具备这种特点 。 因此,结构域也可看作是球状蛋白质的独立折叠单位,有较为独立的三维
空间结构 。
例如,由 2 个亚基构成的 3-磷酸甘油酘脱氢酶,每个亚基由 2 个结构域组成, N-端第 1 -146 个氨
@ 基酸残基形成的第一个结构域能与 NAD+ 结合,第二个结构域(第 147 - 333 氨基酸残基)与底物 3-磷
酸甘油醒结合(图 1-16) 。 有些蛋白质各结构域之间接触较紧密,从结构上很难划分,因此,并非所有
蛋白质的结构域都明显可分 。